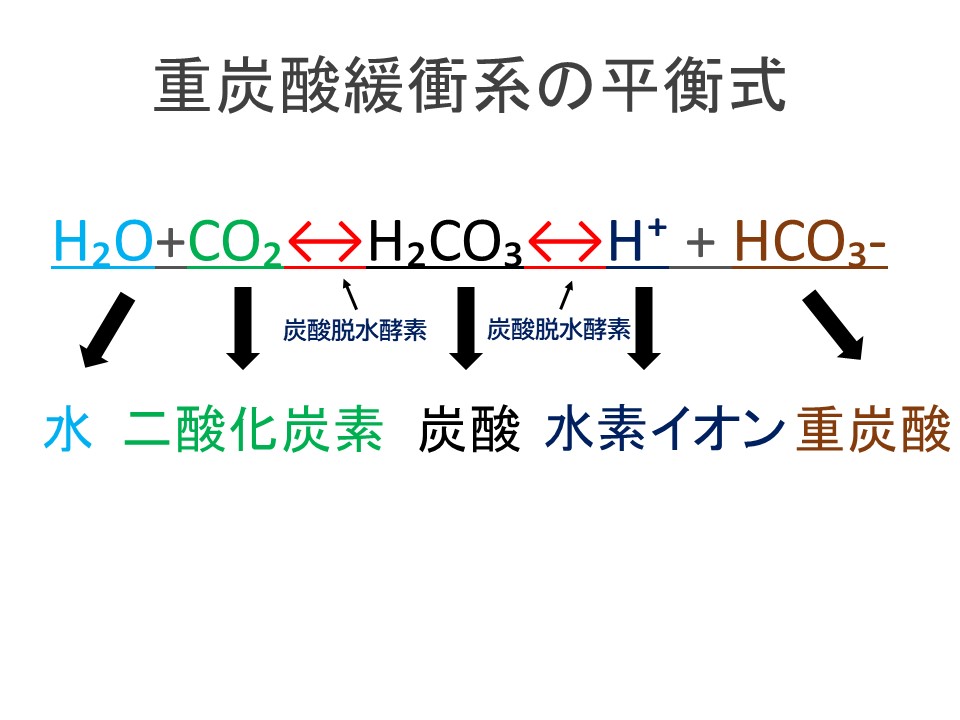
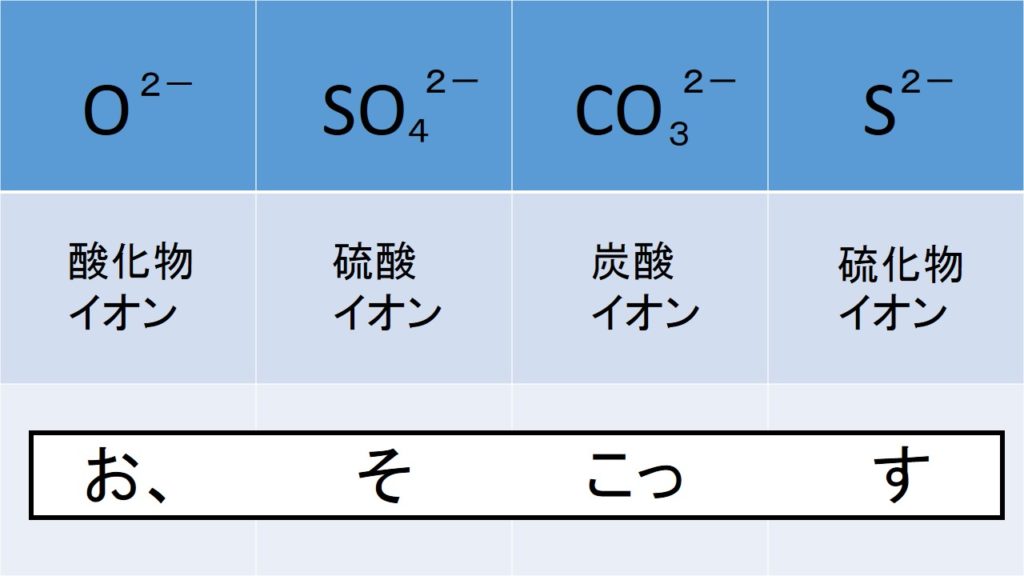
て,カ ルシウムイオン濃度及び炭酸イオン濃度が挙げら れる。図13)は塩化カルシウム及び重炭酸ナトリウムを 添加した水溶液を循環させて,pHの 経時変化を測定し た結果である。水中の重炭酸イオンは,(1)式 イオン式の一覧を中学生向けに作成 しました。 さっそくイオン式の一覧を下に載せますが、 その下にはさらに、 化学式やイオン式の確認と解説 や イオン式の練習問題 も作ったので、ぜひ勉強に活用してください! 陽イオン 赤字がよく出るもの 水素重炭酸イオン 『1年生の解剖学辞典』~ 解剖学をこれから学ぶ人向けの用語解説 ~ 重炭酸イオン とは、または、 炭酸水素イオン とは、 体液 に特にたくさん含まれている陰イオン。 pH を調節し安定させる緩衝液として重要。 化学式は HCO 3 。 言語
Ooki Dic 2 海水中での炭酸成分の解離平衡
炭酸 イオン式
炭酸 イオン式-血液は重炭酸を主なイオンとする緩衝液と捉え、古典的アプローチでは 血液の酸塩基平衡状態を pH=61 log(HCO3/(003xP CO 2 ) ) ( HendersonHasselbalchの式)硝酸イオン 炭酸イオン イオン式 ⇒ イオン名 組 番 名前 陽イオン 1価 2価 NO3- CO32- イオン名→イオン式、イオン式→イオン名 どちらも確実に書けるようにしておきましょう。 電離式(電離を表す式) 組 番 名前 <基本> 電解質 電離式(電離を表す式) 塩化水素 HCl → 塩化ナトリウム NaCl



イオン
廣瀬ほか:維持透析患者の重炭酸イオン濃度の推定式 921 図1 血清無機リン濃度とアニオンギャップの相関図 横軸は血清無機リン濃度(mg///dL)を示し,縦軸はAG(mEq/L)を示す. Age(years) 675±122 36 Mean±SD minimum maximum K(mEq/L) 477±063 35炭酸イオン co32炭酸水素イオン hco3硫酸イオン so42硫酸水素イオン hso4酢酸イオン ch3cooリン酸イオン po43 2次の塩基の電離をイオン反応式で表し,生じた陽イオンの名称を答えよ。 ただし,2価の塩基も1段階で電離したように,1つのイオン反応式で書け。 (1) 水酸化ナトリウム (2) 水重炭酸イオンは中和する酸と同じ量を消費しますので、糸球体でろ過されたあと、尿細管で再吸収し、補充しています。 つまり、腎臓は重炭酸イオンの量を保つ働きもしているわけです。 腎臓の機能が悪くなり、重炭酸イオンが減少すると、体は酸性に傾きます。 反対に、重炭酸イオンが
重炭酸・炭酸緩衝系の目的は、過剰酸または過剰塩基を「中和」し、血漿 pH を限度内に維持することです。 HCO HCO 3は、塩化物の次に血漿に多く含まれる陰イオン であるため、血漿の電気化学的中性の維持に重要です。 血漿中のHCO 3濃度は、HendersonHasselbalchの式を用いて、pCO 2構造式や点電子表記沵ともいわれる。 下図のように,元素記号周囲の点(ン)が価電子1個に相 当する。価電子を表す点については,①上から始めて昷計回 りに1つずつ暯いていく,② 元素記号の四方に1個ずつ点 が暯かれたら、その次は元の点の横に並べて暯く。窒素原子 の上の一対の電子が 炭酸マグネシウム(Magnesium carbonate) は,化学式 MgCO3 で表される無機化合物です。 目次 Table of contents 1 名称 Names 2 化学式と構造 Formulas & structures 3 物質情報 Properties 4
2 価の炭酸の例を紹介する。炭酸の pH も, pH 計算の基礎に従い,連立方程式を解くことで求められる。 ① 電離平衡 炭酸は, 電離平衡で紹介したように,二酸化炭素との平衡を含む化学平衡であるが,ここでは,見かけ上の電離平衡を用いる。例えば、前式の通り、石灰 水にco2を ルシウムイオン)とhco3(炭酸水素イオンまたは重炭酸イオン)を生じる。そのcahco3 の 水溶液を熱すると、再びcaco3の沈殿ができる。 caco3 co2 h2o ⇌ ca2 2hco33.3 気体発生の反応 アルカリ土類金属元素の炭酸塩は加熱され分解し、co2(二酸表にイオン式をかこう。(覚えるのに活用してください) 1 9 2 10 3 11 4 12 5 13 6 14 7 15 8 *ポイント ② 原子が+と-のどっちの電気を帯びるかを覚える。 ③ 原子が帯びる電気が1~2のいくつか覚える。 ④ 電気の種類と数は原子記号の右上に。数・+or-の順。(数の1は省略) (原子の数を表す



中学で覚えるイオン 酸とアルカリ 3年理科 Takaの授業記録11




炭酸カルシウム Caco3 の化学式 組成式 構造式 電子式 分子量は
重炭酸イオン濃度は腎尿細管における再吸収量の増減により調節される.代謝性アシドーシスではHCO 3 .一般に血清K濃度はNaに比べ小さく安定していることから,AG=Na +〔Cl - +HCO 3 - 〕の式が用いられ,基準値は12mmol/l である. 基準値・異常値を見る;イオン nh 4 亜鉛イオン zn2 炭酸イオン co 3 2マグネシウム イオン mg2 バリウム イオン ba2 硫酸イオン so 4 2陽イオン イオン式 ひたすら書いて覚える!! 水素イオン ナトリウム イオン カルシウム イオン アンモニウ ムイオン 銅イオン 陰イオン イオン式(4)炭酸イオン 1.塩化物の沈殿を2種類化学式で答えなさい。 2.中性~弱塩基性で沈殿する硫化物を4種類化学式で答えなさい。 3.過剰の水酸化物イオンで溶ける水酸化物を3種類化学式で答えなさい。 4 アルカリ土類の水酸化物と,マグネシウムの水酸化物の違いを説明しなさい。 5



炭酸イオンco3 2 が双極子モーメントをもたない理由を教えてください Yahoo 知恵袋



無料 イオン式アプリ 化学式の次はこれ 女子用 Para Android Apk Baixar
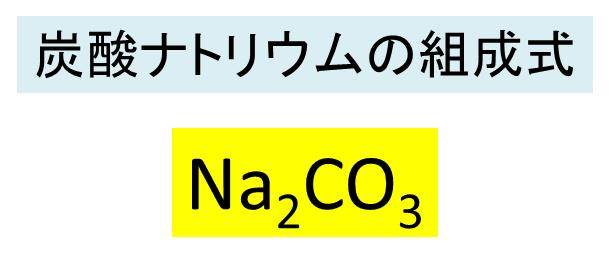
この式を分かりやすく説明すると、以下のようになります。 二酸化炭素は水に溶けると、最終的に「重炭酸イオンhco3-」と「水素イオンh+」に分かれます。 見てください! 水に溶けると、二酸化炭素は水素イオンh+を放出していますよね? そのため、二酸化炭素は酸であるということが ナトリウムイオンと炭酸イオンを、21の比率で組み合わせることにより電荷を中和できる ため、Na 2 CO 3 という組成式を導き出せるでしょう。 化学式を与えられていない場合には、イオン式を覚えていないと、陽イオンと陰イオンをどのような比率で組み合わせたら良いかがわかりませ2.化学式 単体 化合物 分子 分子× 分子 分子× アンモニウムイオン 銅イオン 炭酸イオン 硝酸イオン 2 ba coo ch 3 - バリウムイオン 酢酸イオン 陽イオン 陰イオン 水素イオン h+ 塩化物イオン cl- ナトリウムイオン na+ 水酸化イオン oh- カリウムイオン k+ 硝酸イオン no 3- 銀イオン ag



4 酸塩基平衡 塩基 とは 重炭酸イオンのことである




21 号 排水の処理方法及び排水の処理装置 Astamuse
中3理科。「酸性」「アルカリ性」がイオンで分かる? "水酸化物イオン"?? ぐはぁっ(ガクッ)倒れ込む中学生。立て、立つんだトォォォォ~ッ! オール5家庭教師、見参ッ!「酸性」「アルカリ性」が一発で分かるコツ!(ビシッ)見よ、プロの技。Naのイオン式 水素イオン Hの名称 硝酸イオン 炭酸水素イオンのイオン式 Cr2O72− 二クロム酸イオンのイオン式 SO42− 硫酸イオンのイオン式 PO43− リン酸イオンのイオン式 Fe3 鉄イオンのイオン式 塩化カリウム KClの名称 酸化ナトリウム Na2Oの名称 硝酸カルシウム Ca(NO3)2の名炭酸 たんさん carbonic acid 化学式 H 2 CO 3 。二酸化炭素が水に溶けて生じる弱い二塩基酸。水溶液としてのみ存在する。炭酸の溶解度は共存する塩の濃度,水素イオン濃度,温度および二酸化炭素の分




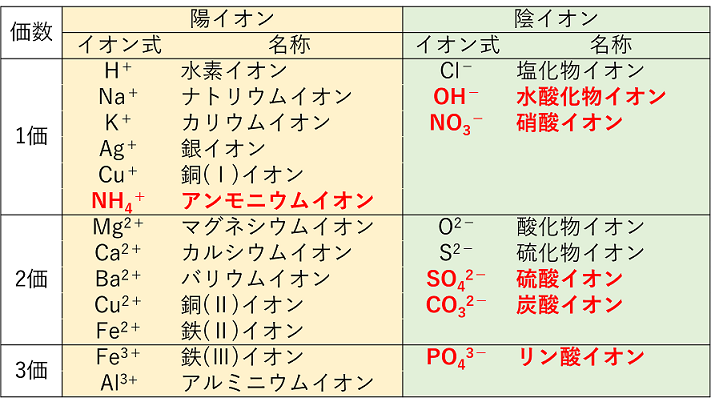
イオン式の一覧 中学生用



1
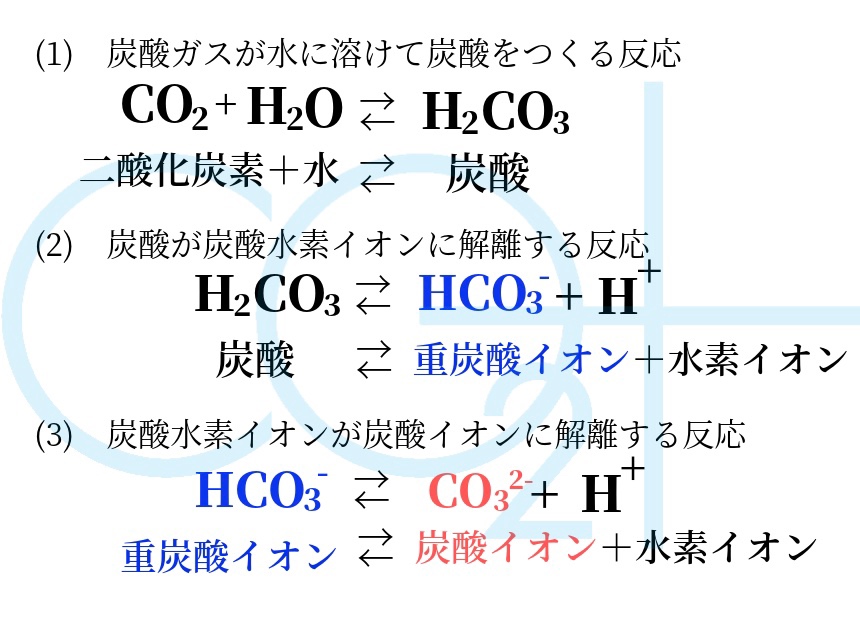
化学式 塩の分類 水溶液中の炭酸イオンの一部が水と反応すると, CO 3 2- +H 2 O⇔HCO 3 - +OH - したがって,OH - >H + 塩基性 水溶液中の炭酸水素イオンの一部が水と反応すると, HCO 3 - +H 2 O⇔H 2 CO 3 +OH - したがって,OH - >H + 塩基性 (H 2 CO 3 ⇔CO 2 +H 2 O この平衡は左にイオン式 元素記号が,化学語の単語だとすると,単原子イオンのイオン式はその活用形だ。何度も繰り返し 覚えたか確認しよう。 co2+h2o ←→h +hco3炭酸水素イオン hco3→h +co32 炭酸イオン *h2co3→h ← +hco3と表してもよい。 3価の酸(三塩基酸とも呼ばれ 水と二酸化炭素から炭酸のできる反応式は H 2 O(l) CO 2 (aq) ⇄ H 2 CO 3 ですが、文献では、その平衡定数は25℃で17×103 だそうです(J Phys Chem 1969, 73, 3351–3356)。ということは、純水中に炭酸はほとんどないという事ですね。あれっ?。中学校や高校で習っ




組成式とは 分子式との違いも解説 一覧表つき 高校生向け受験応援メディア 受験のミカタ




都立高校入試理科のイオンの傾向と対策 イオン式 電離式を押さえよう 高校入試徹底対策ガイド
カテゴリー タグ 「さわにい」のお勧め 地学 音 電流と回路 遺伝 練習問題炭酸水素ナトリウム(重曹)は化学式nahco 3 であらわされる化合物で、体内でna とhco 3に解離する。 hco 3は重炭酸イオンと呼ばれ、酸を中和し回答 ベストアンサー Anju 3年以上前 H2CO3が炭酸です CO3が炭酸イオンです HCO3は炭酸水素イオンです さき 3年以上前 ありがとうございます。




中3理科 イオン式 暗記動画と練習プリント Pikuu
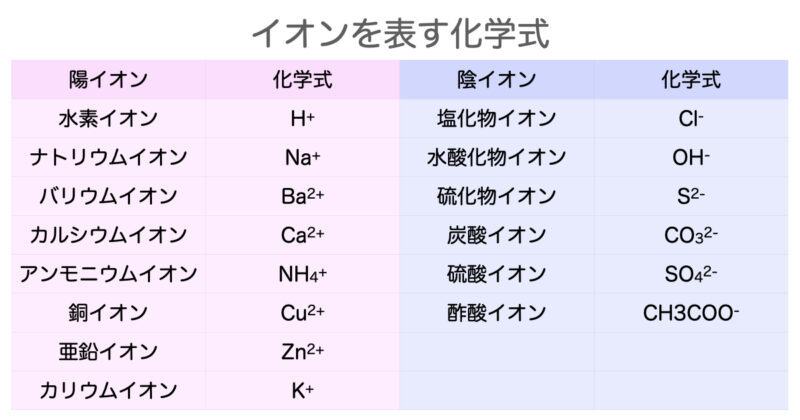



これだけは覚えたいイオンを表す化学式 イオン式 一覧 Hiromaru Note




理科 中3 3 イオン式 Youtube




炭酸ナトリウム Na2co3 の化学式 分子式 構造式 電子式 イオン式 分子量は 炭酸ナトリウムの工業的製法




気象庁 海洋の健康診断表 総合診断表 第2版




イオン式 分類 単原子イオン 多原子イオン Chemihack おうちで学べる化学



簡単に理解できる酸塩基平衡 認定看護師のブログ 働く人を支える アイエスイノベーション




炭酸塩 Wikipedia




炭酸の化学式 分子式 構造式 電子式 イオン式 分子量は 炭酸の代表的な反応式は




中学3年の理科 動画 イオン式の問題 電離 19ch



炭酸イオンのイオン式をなんと読みますか たとえばアンモニ Yahoo 知恵袋




Excel イオン式 電離式の練習用教材 中学理科ポイントまとめと整理 オンラインショップ




イオン名 合ってますか Clearnote




イオン



イオン式とは 価数とは 書き方や語呂合わせの覚え方 暗記法まとめ 高校化学の問題の解き方も 受験の相談所
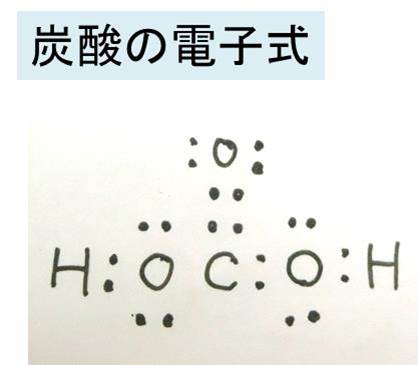



炭酸の化学式 分子式 構造式 電子式 イオン式 分子量は 炭酸の代表的な反応式は




炭酸ナトリウム Na2co3 の化学式 分子式 構造式 電子式 イオン式 分子量は 炭酸ナトリウムの工業的製法



2




イオン式の覚え方とかあったら教えていただけると助かります お願いします Clearnote




モノマナビ研究所



高一化学 炭酸イオンとマグネシウムイオンの組成式はこれで合ってます Yahoo 知恵袋




イオン式の一覧 中学生用



4 酸塩基平衡 塩基 とは 重炭酸イオンのことである




Excel イオン式 電離式の練習用教材 中学理科ポイントまとめと整理 オンラインショップ




化学基礎 イオン式 Youtube




イオン式の一覧 中学生用



炭酸カルシウム You Iggy




高校化学基礎 単原子イオンと多原子イオン 映像授業のtry It トライイット




イオン式とは 価数とは 書き方や語呂合わせの覚え方 暗記法まとめ 高校化学の問題の解き方も 受験の相談所



4 酸塩基平衡 塩基 とは 重炭酸イオンのことである




炭酸塩 Wikipedia
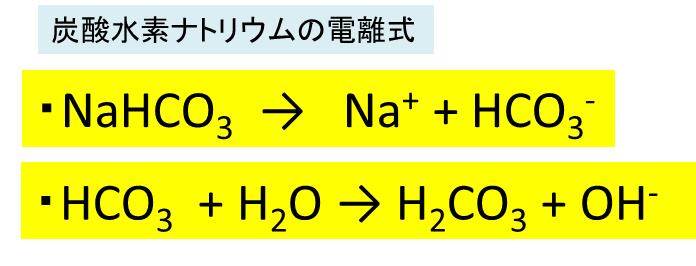



炭酸水素ナトリウム Nahco3 の化学式 分子式 構造式 電子式 イオン式 分子量は 炭酸ナトリウムの工業的製法
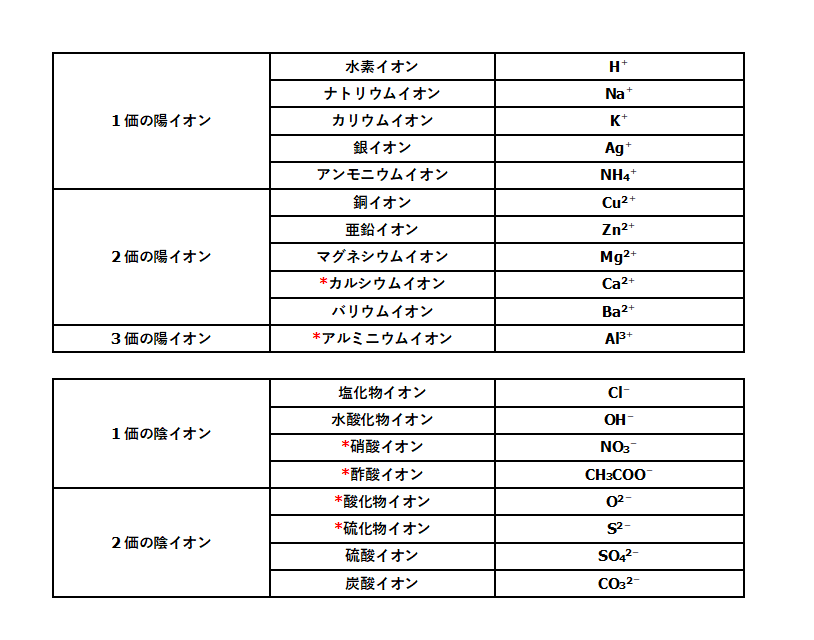



中3化学 イオンとは 中学理科 ポイントまとめと整理




高校化学基礎 単原子イオンと多原子イオン 映像授業のtry It トライイット



化学で質問です 炭酸イオンは なぜco32 になるのですか なぜoが3 Yahoo 知恵袋




炭酸水素ナトリウムの水溶液が塩基性なのはなぜ 化学反応式を解説 地学博士のサイエンス教室 グラニット




炭酸の化学式 分子式 構造式 電子式 イオン式 分子量は 炭酸の代表的な反応式は



4 酸塩基平衡 塩基 とは 重炭酸イオンのことである
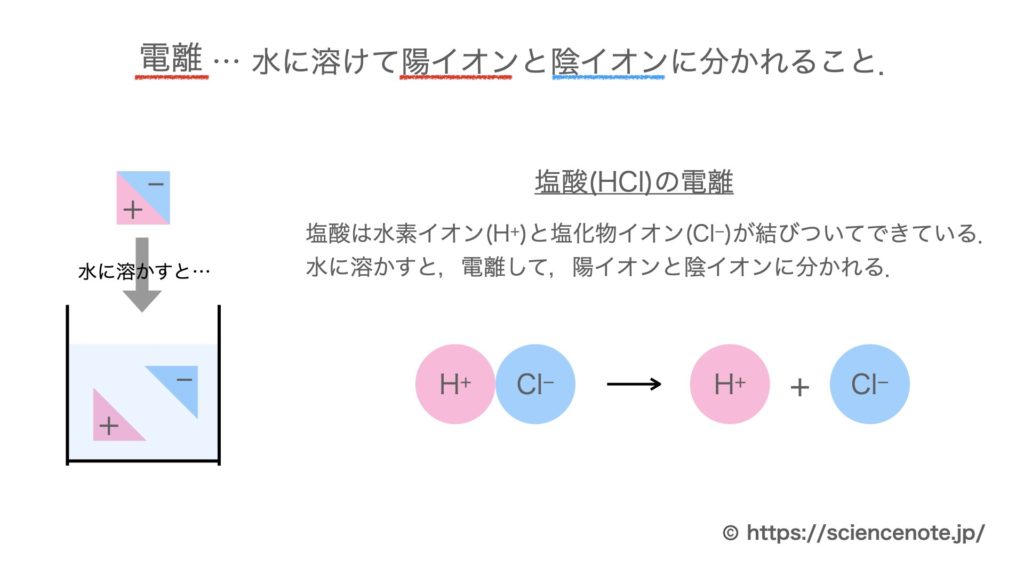



電離とは 電離式まとめ10選 中学化学 Hiromaru Note



1
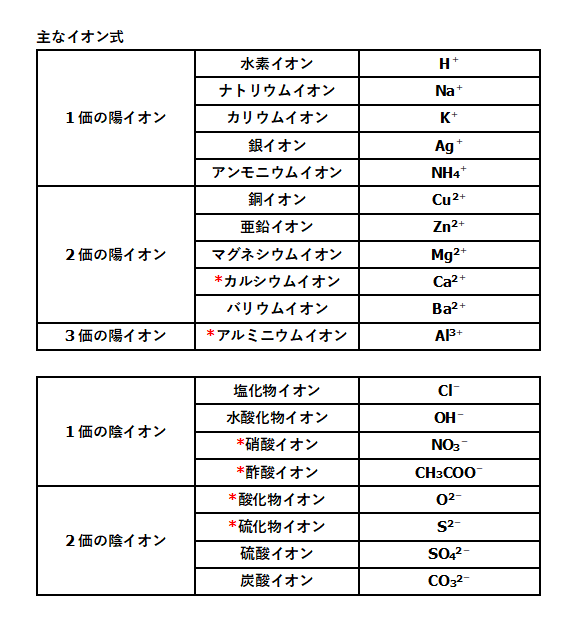



イオン式 電離式まとめ 中学理科 ポイントまとめと整理




高校化学基礎 イオン式とイオンの価数 練習編 映像授業のtry It トライイット



ジェンツーペンギン 暗記プリント 高校 化学基礎 イオン式 イオン式覚えられなくて 緊急事態宣言な人 使ってみてください 高校 定期テスト 化学 緊急事態宣言 T Co Kybbwexfwm Twitter




炭酸イオンのイオン式について質問です Co32 と表記されますが これ 化学 教えて Goo




炭酸 Wikipedia




イオン式 電離式まとめ 中学理科 ポイントまとめと整理




Excel イオン式 電離式の練習用教材 中学理科ポイントまとめと整理 オンラインショップ
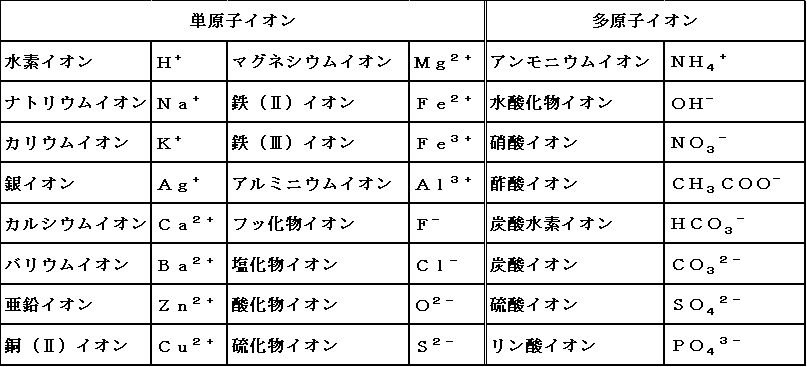



化学 科学 Pararinpoppin In Hell



炭酸塩 Wikipedia



入試に必要な化学式とイオン式を最速で覚える方法



炭酸ナトリウム Na2co3 の化学式 分子式 構造式 電子式 イオン式 分子量は 炭酸ナトリウムの工業的製法



水酸化カリウム 電離式




中3化学 イオン 知識問題 中学理科の問題パターンと練習問題




イオン式とは イオン式の一覧と読み方を一挙公開 化学受験テクニック塾




イオン式とは イオン式の一覧と読み方を一挙公開 化学受験テクニック塾
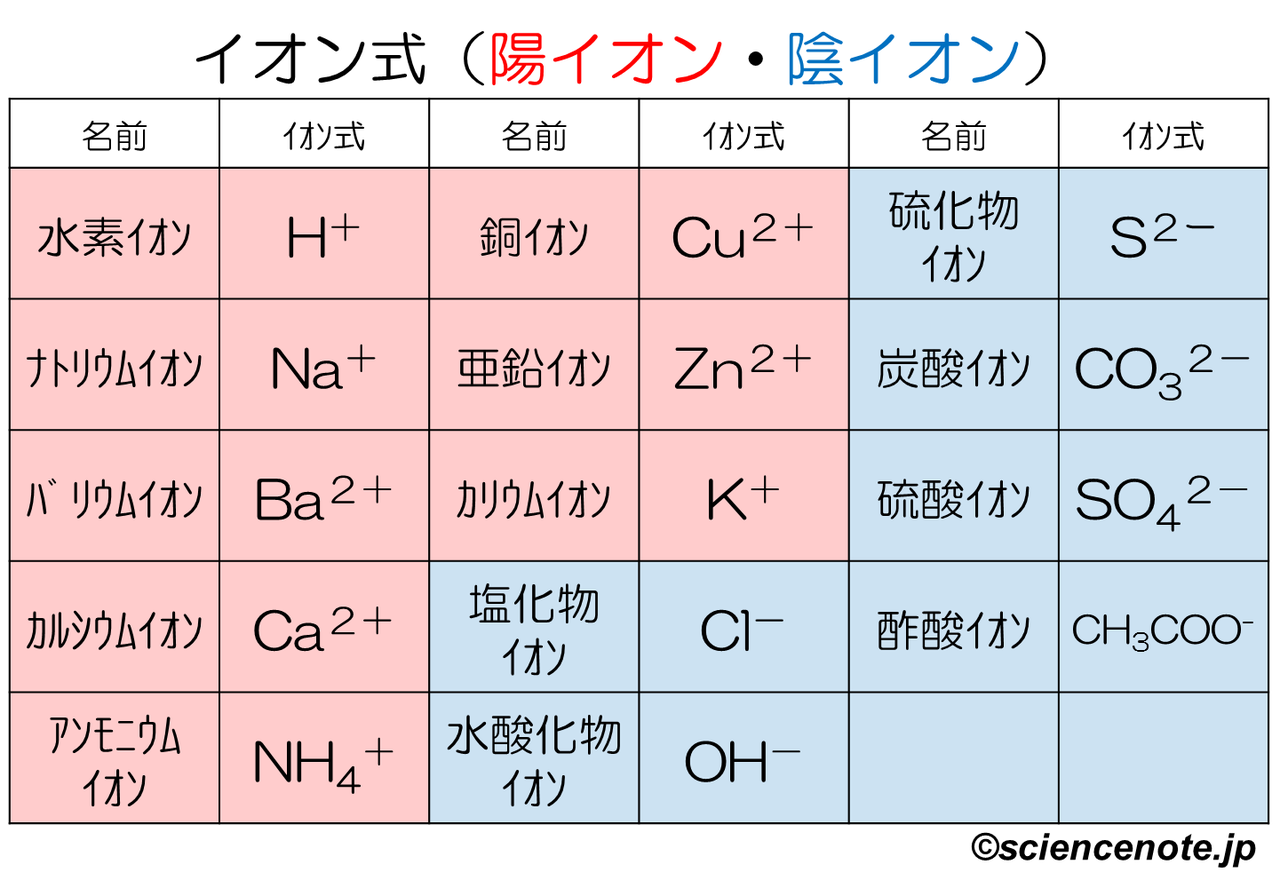



これだけは覚えたいイオンを表す化学式 イオン式 一覧 Hiromaru Note




Excel イオン式 電離式の練習用教材 中学理科ポイントまとめと整理 オンラインショップ



2




アンモニウムイオンと炭酸イオンの組み合わせはなんですか Clearnote



電子式について以下の問題の解き方が分かりません 以下の分子 イ Yahoo 知恵袋




炭酸の電離式を教えてください Clearnote




中3 中3理科 イオンの種類とイオン式 中学生 理科のノート Clearnote



中学生です 炭酸水の電離式と その理由を教えてください お Yahoo 知恵袋




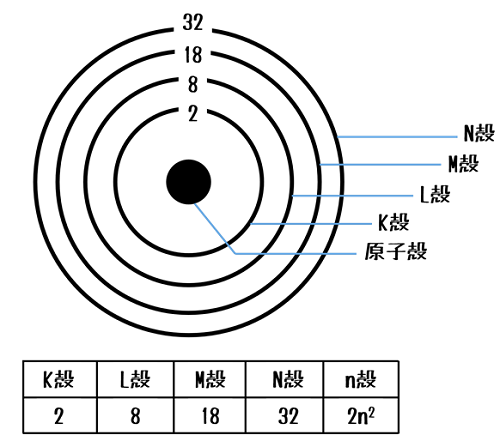
理科3年 化学 イオン 電池 酸アルカリ エネルギー イオン 要点 原子 イオン 原子核は の電気を帯びた陽子と電気を帯びていない中性子から成り立っている 原子核の周りを の電気を帯びた電子が飛び回っている 陽子と電子の数は同じである



Ooki Dic 2 海水中での炭酸成分の解離平衡




危険物資格取得のための高校化学no 10 組成式 F M サイエンスブログ




炭酸ナトリウム Wikipedia



ナトリウムイオンと炭酸イオンの組成式についてです この場合炭 Yahoo 知恵袋




電子式 イオン式から配位結合 錯イオンの仕組みまでわかりやすく解説



2




イオンです 空欄に何が入るかを教えてください Clearnote



誤解していませんか 重炭酸浴と炭酸浴の大きな違い



中学で覚えるイオン 酸とアルカリ 3年理科 Takaの授業記録11




4 2 分子量 式量 おのれー Note




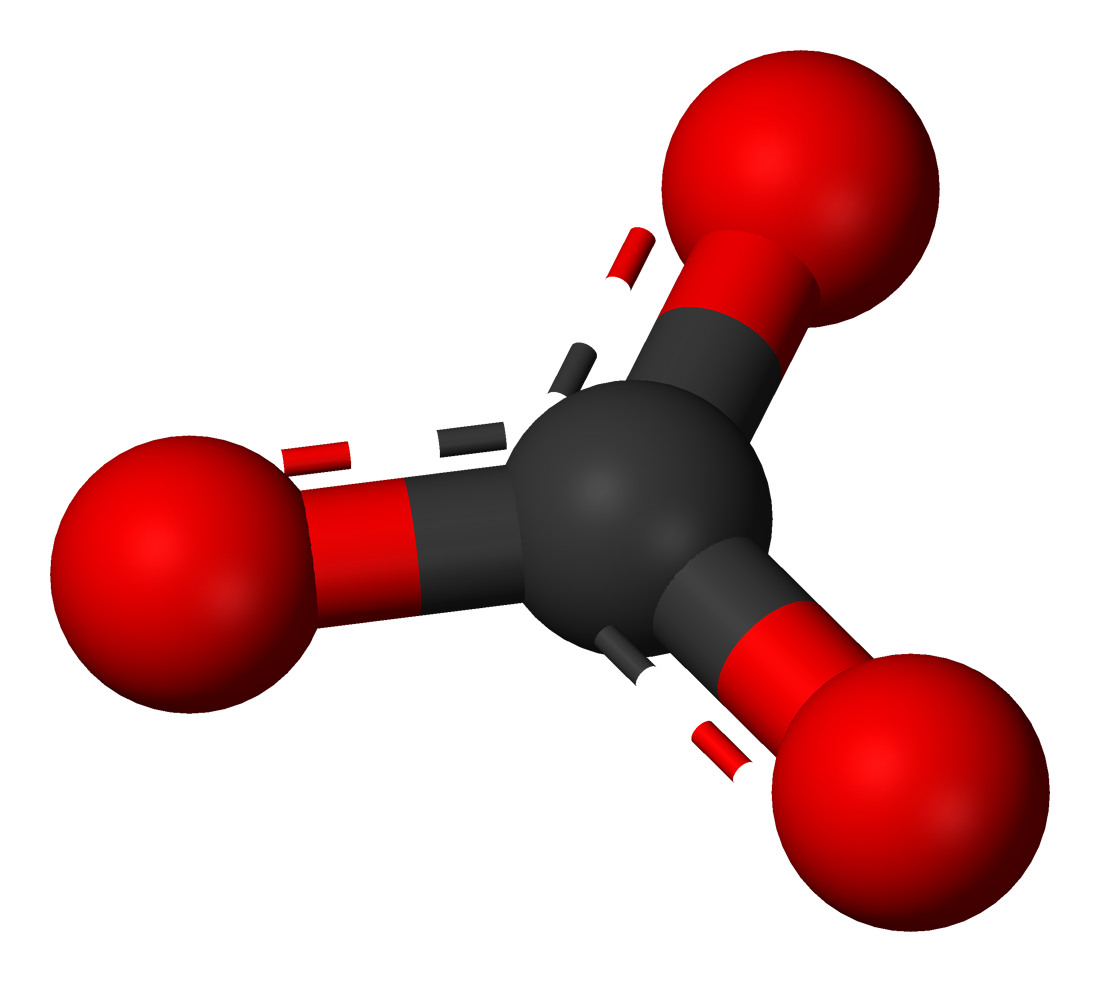
炭酸イオン 構造式 化学受験テクニック塾




水溶液とイオン8 練習問題と積み上げプリント ラスカルのブログ



スズケンdiアワー 平成14年7月11日放送内容より スズケン Di実例集 137 昭和大学病院 薬剤部 竹ノ内 敏孝 血漿重炭酸イオン濃度の算出法 本日は 酸 塩基代謝障害と血漿重炭酸イオン濃度の算出法についてお話させていただきます まず 酸 塩基




イオン式とは イオン式の一覧と読み方を一挙公開 化学受験テクニック塾




これだけは覚えたいイオンを表す化学式 イオン式 一覧 Hiromaru Note




Excel イオン式 電離式の練習用教材 中学理科ポイントまとめと整理 オンラインショップ




気象庁 海洋の健康診断表 総合診断表 第2版



炭酸バリウム You Iggy




イオン式 On Vimeo




高校化学 イオン 多原子イオン オンライン無料塾 ターンナップ Youtube
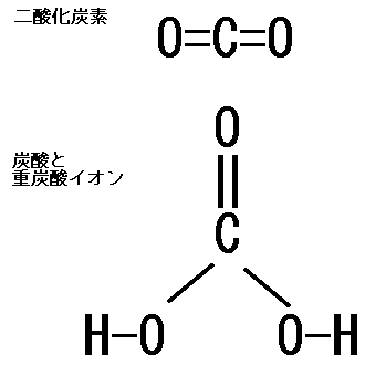



水に溶けた二酸化炭素と炭酸と重炭酸イオン ラジオメーター学術情報サイト Www Acute Care Jp



イオン式
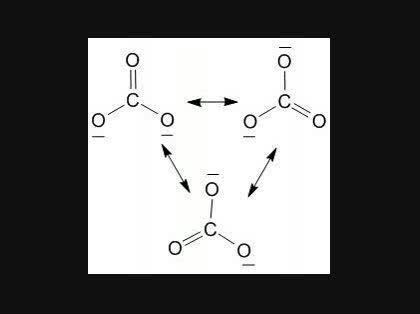



共鳴の概念 化学 炭酸イオン中の3つの炭素 酸素結合の長さは等し 化学 教えて Goo




中3化学 化学式の作り方 知識問題 中学理科の問題パターンと練習問題
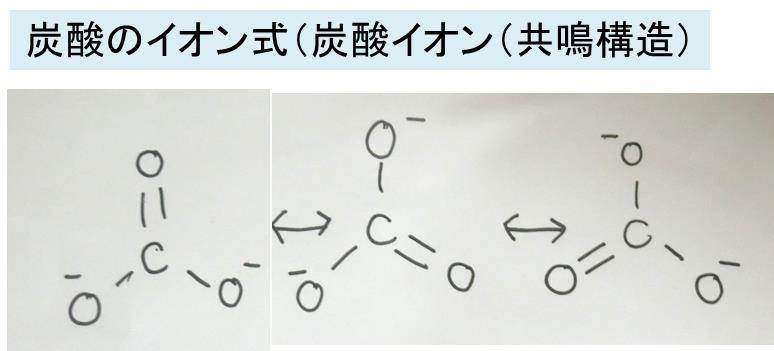



炭酸の化学式 分子式 構造式 電子式 イオン式 分子量は 炭酸の代表的な反応式は




重炭酸塩陰イオン 化学の構造式と分子モデル 分子のベクターアート素材や画像を多数ご用意 Istock




学習ノート 勉強垢 おしゃれまとめの人気アイデア Pinterest 𝙲𝚒𝚗𝚍𝚢 𝚓𝚓𝚘𝚗𝚎𝚜 21 中学 勉強 理科 中学 学習ノート



中学で覚えるイオン 酸とアルカリ 3年理科 Takaの授業記録11



炭酸イオンの電子式 この赤い丸で囲んだ酸素の電子の数が6個なのが Yahoo 知恵袋




中3 イオン式 まとめ 中学生 理科のノート Clearnote



0 件のコメント:
コメントを投稿